Leukemia|我院鞠振宇团队及汪虎团队与浙大生命科学研究院沈立合作解析HMCES对长期造血干细胞的保护作用并提出白血病治疗的新靶点
发布单位:衰老与再生医学研究院 发布时间:2022-01-27
长期造血干细胞(long-term hematopoietic stem cell, LT-HSC)通过自我更新和多向分化维持机体的终身造血。在稳态下,这群稀有的成体干细胞通过保持静息状态以减少活性氧(ROS)的产生从而保证其基因组的稳定性。然而,当遭受造血压力刺激时,LT-HSC会退出静息状态并快速活化和增殖,从而导致细胞内的ROS水平迅速升高,进而产生无碱基位点(AP位点)等DNA氧化损伤。当这些AP位点出现在LT-HSC增殖过程中产生的单链DNA上时,由于缺乏互补链作为修复模板,它们很容易在AP核酸内切酶或者跨损伤合成(TLS)易错聚合酶的作用下产生DNA双链断裂(DSB)或突变。因此,在LT-HSC的激活过程中,及时地修复或者保护单链DNA上的AP位点,对于维持其基因组稳定性和再生能力至关重要,但是这种保护机制仍然不明确。
2022年1月17日,浙江大学生命科学研究院沈立实验室联合暨南大学衰老与再生医学研究院院长鞠振宇课题组和研究员汪虎课题组在Leukemia杂志上在线发表了题为“HMCES safeguards genome integrity and long-term self-renewal of hematopoietic stem cells during stress responses”的研究论文。论文研究的HMCES(5-Hydroxymethylcytosine Binding, ES Cell Specific)是一个古老并在进化上高度保守的基因,其编码的蛋白最初被认为是DNA上5-羟甲基胞嘧啶修饰的特异性结合蛋白(5hmC reader),但近期的生化研究发现HMCES的主要功能是识别并共价交联至单链DNA上的AP位点,从而有效地抑制DSB或DNA突变的产生。该研究通过构建Hmces基因敲除小鼠、LT-HSC移植等手段揭示了HMCES在压力造血过程中维持LT-HSC自我更新和基因组稳定性的关键作用。

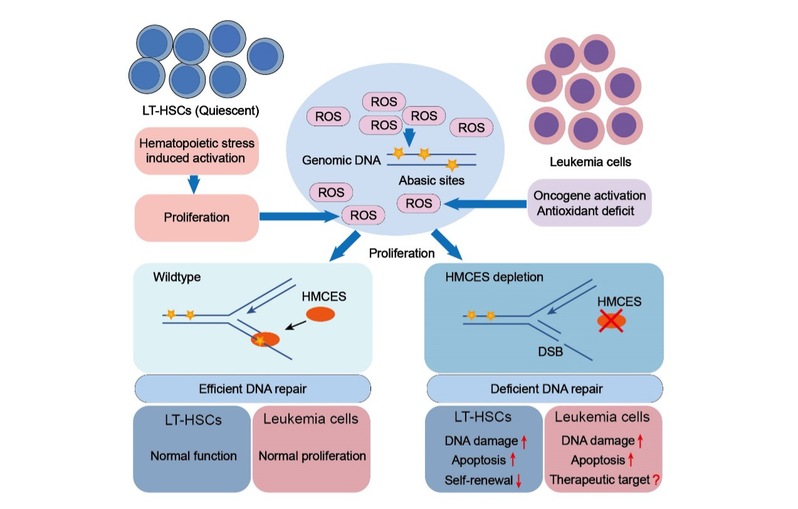
团队的研究人员发现,虽然HMCES在配子和骨髓中高表达,但是Hmces敲除小鼠能够正常发育且雌性和雄性均可育,稳态下的正常造血维持也并不依赖HMCES。然而在LT-HSC移植、5-FU和pI:pC等造血压力下,随着LT-HSC被激活,Hmces敲除的LT-HSC数量显著减少,同时Hmces敲除的LT-HSC中出现了较高的DNA损伤。除了对LT-HSC激活引起的内源性DNA损伤压力更加敏感外,研究人员还发现Hmces敲除小鼠在亚致死剂量电离辐射后出现了骨髓衰竭和死亡,并且该表型可被移植野生型小鼠的骨髓所回补。通过转录组测序,研究人员发现Hmces敲除LT-HSC中的DNA损伤修复通路呈现出了广泛的下调。因此,HMCES对单链DNA上AP位点的保护以及对DNA损伤修复通路的调控共同保证了LT-HSC在压力造血过程中维持基因组稳定性和自我更新能力。
快速增殖的白血病细胞中也存在较高的ROS水平。研究人员还发现HMCES也能使白血病细胞耐受ROS引起的DNA氧化损伤,因此对于白血病细胞的生存是必不可少的。HMCES在急性淋巴细胞白血病(ALL)病人样品中异常高表达,并且HMCES的高表达与ALL患者的不良预后密切相关。由于稳态下的正常造血并不依赖HMCES,因此 HMCES有望成为治疗白血病的新靶点,可以在不影响正常造血功能的前提下选择性地清除白血病细胞。
综上所述,该研究不仅揭示了HMCES在压力造血过程中保护LT-HSC基因组稳定性和自我更新的关键作用,而且发现了其与ALL的临床相关性,为白血病治疗提供了潜在的新靶点。
该研究受到了国家自然科学基金面上项目、优秀青年科学基金、国家科技部重点研发计划、浙江省杰出青年科学基金等项目的资助。浙江大学沈立教授、暨南大学鞠振宇教授和汪虎研究员为本文的共同通讯作者,博士研究生潘应昊和左红娜为本文的共同第一作者。
原文参考链接:https://www.nature.com/articles/s41375-021-01499-5
